高彩霞研究组利用环状RNA开发基于Cas12a的引导编辑器
基于CRISPR-Cas9的引导编辑器(prime editors, PEs)能同时实现任意碱基类型的精准替换,及小片段的精准插入、替换和删除。目前,几乎所有的引导编辑器均是依赖于Cas9蛋白开发而成,但Cas9蛋白存在尺寸较大、脱靶效应高和受限于G/C-rich区域编辑的缺点,限制了引导编辑器的广泛应用。如何进一步提升引导编辑器的编辑精度、消除靶点序列限制并降低递送难度是基因组编辑领域亟待解决的重要技术难题。
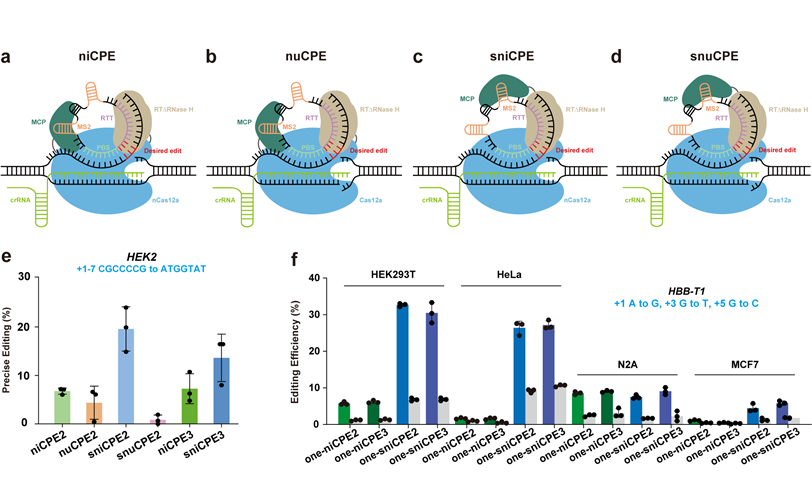
与Cas9蛋白相比:Cas12a蛋白和其crRNA分子量都较小,易于递送;Cas12a具有更低的脱靶效应,适合疾病治疗;Cas12a蛋白识别基因组A/T-rich区域,能够编辑Cas9蛋白无法编辑的位点。所以,基于Cas12a开发的引导编辑器将在基因治疗和农业生产上具有广泛的应用潜力。研究证明,Cas12a蛋白具有切割pegRNA(prime editing guide RNA)的特点,所以传统的pegRNA并不适用于Cas12a引导编辑器的开发。利用Cas12a蛋白的不同形式,高彩霞研究团队开发了适合不同场景的基于环状RNA的引导编辑系统CPEs(circular RNA-mediated prime editors):(1)基于切口酶的引导编辑器niCPE(nickase-dependent CPE, 图1a);(2)基于双链核酸酶的引导编辑器nuCPE(nuclease-dependent CPE, 图1b);(3)可拆分niCPE的引导编辑器sniCPE(split nickase-dependent CPE, 图1c);(4)可拆分nuCPE的引导编辑器snuCPE(split nuclease-dependent CPE, 图1d)。 niCPE和nuCPE在人类细胞系HEK293T中效率分别高达24.89%和10.42%,适合慢病毒等大分子量递送系统。sniCPE和snuCPE在HEK293T细胞中效率分别高达40.75%和3.19%,适合AAV递送。除了HEK293T细胞以外,niCPE和sniCPE在HeLa、N2A、MCF7等细胞中也能有效产生精确的引导编辑(图1e-f)。
研究人员把靶向多个位点的多个crRNA串联在一起,置于环状RNA的表达框中,并把靶向多个位点的RTT-PBS序列也串联在环状RNA表达框中。实验结果表明,这样的设计可以高效实现双基因、三基因甚至四基因的引导编辑。研究人员进一步检测了CPE引导编辑器的脱靶效应,结果表明CPE具有优良的特异性,几乎没有检测到脱靶效应。低脱靶效应、高编辑效率的CPE系统为利用各种核酸酶开发为新型引导编辑系统提供了通用范式,多类型的CPE系统在生物研究、疾病治疗和作物育种等多场景中将发挥巨大的潜力。
该研究成果以“Prime editing using CRISPR-Cas12a and circular RNAs in human cells”为题于2024年1月10日在线发表在Nature Biotechnology杂志上(DOI: 10.1038/s41587-023-02095-x)。高彩霞研究组助理研究员梁荣洪、博士生贺子欣、齐禾生科生物科技有限公司Kevin Tianmeng Zhao博士为该论文的共同第一作者,高彩霞研究员为通讯作者。该研究得到科技创新2030-生物育种重大项目、国家重点研发计划和新基石科学基金的经费资助。
附件下载:
